PolTREG S.A. to spółka biotechnologiczna, która rozwija na etapie klinicznym innowacyjną generację terapii z zastosowaniem komórek T-regulowanych (TREGS) w leczeniu chorób autoimmunologicznych. Ma szansę na terapię first-in-class w cukrzycy typu 1 oraz status przełomowej terapii w stwardnieniu rozsianym.
PolTREG zamierza podpisać umowę z AZTherapies (USA) – jednym z globalnych liderów w obszarze badań nad CAR-TREG - i rozpocząć współpracę w celu rozwoju terapii w leczeniu chorób neurologicznych o podłożu autoimmunologicznym i zapalnym.
O PolTREG S.A.
PolTREG powstał w 2015 roku jako spin-off z Gdańskiego Uniwersytetu Medycznego w celu kontynuacji programu naukowego, w którym prowadzono badania i próby kliniczne w cukrzycy typu 1 u dzieci. Badania kliniczne z wykorzystaniem limfocytów TREGS w tej chorobie rozpoczęły się w 2010 roku i były prowadzone m.in. przez twórców metody, założycieli i znaczących akcjonariuszy Spółki: prof. dr. hab. n. med. Piotra Trzonkowskiego, prof. dr. hab. n. med. Małgorzatę Myśliwiec oraz prof. dr. hab. n. med. Natalię Marek-Trzonkowską.
Spółka koncentruje się na opracowaniu platformy polifarmakologicznej będącej podstawą opracowywania innowacyjnych terapii z wykorzystaniem komórek (limfocytów) T-regulatorowych (TREGS), a także pracach nad terapiami skojarzonymi opierającymi się o leczenie TREGS oraz np. przeciwciałami. Terapie takie stanowią nowość w endokrynologii, tym samym otwierając nowy obszar działalności medycznej, czyli immunoendokrynologię (np. TREGS w połączeniu z rituximabem - lekiem przeciwnowotworowym i immunosupresyjnym). Spółka prowadzi również prace badawczo-rozwojowe nad wykorzystaniem bardziej zaawansowanych TREGS antygenowo specyficznych i genetycznie modyfikowanych CAR-TREGS (łącznie określane jako Treg 2.0), które mogą w przyszłości stanowić podstawę opracowywanych terapii, ponieważ umożliwiają modyfikację TREGS pacjenta w laboratorium w przypadku braku określonych cech, albo jeśli jest możliwość ich modyfikacji w celu zwiększenia skuteczności przeciw konkretnej chorobie.
Obszarem terapeutycznym, w którym wykorzystywane będą terapie Spółki, są choroby autoimmunologiczne, czyli takie, w których układ odpornościowy atakuje własny organizm. Terapie, nad którymi pracuje Spółka zaliczane są do tzw. terapii komórkowych, które polegają na wykorzystaniu ludzkich komórek i są zaliczane do najbardziej zaawansowanej obecnie grupy leków, tzw. „żywych leków”. Spółka realizuje obecnie na różnym etapie zaawansowania 2 główne grupy projektów badawczo-rozwojowych (terapii cukrzycy typu 1 u dzieci oraz stwardnienia rozsianego) stanowiące platformę do opracowania skutecznych i innowacyjnych terapii na różne choroby autoimmunologiczne oraz projekt rozwoju platformy Treg 2.0.
Terapia z wykorzystaniem komórek TREGS rozwijana przez PolTREG w leczeniu cukrzycy typu 1 u dzieci i w stwardnieniu rozsianym jest – według wiedzy Spółki – najbardziej zawansowana w rozwoju klinicznym na świecie.
Informacje o ofercie
Czyniąc kolejny krok na swojej ścieżce rozwoju Spółka postanowiła zadebiutować na Giełdzie Papierów Wartościowych w Warszawie. Rozpoczynająca się oferta publiczna PolTEGR S.A. obejmuje akcje, które łącznie będą stanowiły 35,76% kapitału zakładowego spółki i uprawniały do 32,38% głosów na WZ. Łączna wartość oferty może sięgnąć 175,1 mln zł brutto (w tym 139,9 mln zł brutto z nowej emisji), a wycena Spółki na potrzeby oferty publicznej to niemal 490 mln zł.
Zapisy na akcje PolTREG S.A. w ofercie publicznej w transzy dla inwestorów indywidualnych składać można od 19 do 25 października 2021 roku, a w transzy dla inwestorów instytucjonalnych od 27 do 29 października (budowa księgi popytu potrwa od 19 do 26 października). Transza dla inwestorów indywidualnych ma stanowić 10-20% całej emisji.
Zapisy na akcje od inwestorów indywidualnych przyjmowane są w Domach Maklerskich:
- IPOPEMA Securities S.A.,
- mBank S.A.,
- Dom Maklerski Banku Ochrony Środowiska S.A.
Obecni akcjonariusze w większości zawiązali lock-up (akcje stanowiące około 10,7% obecnego kapitału zakładowego nie zostały objęte lock-upem na dzień 11 października):
- założyciele i znaczący akcjonariusze na 36 miesięcy,
- najwięksi akcjonariusze na 12 miesięcy,
- część pozostałych akcjonariuszy na okres od 3 do 6 miesięcy.
Zgodnie z harmonogramem przydział akcji może nastąpić 29 października, a oczekiwany pierwszy dzień notowań do około 23 listopada br.
Jedynym prawnie wiążącym dokumentem ofertowym zawierającym informacje o ofercie akcji PolTREG S.A. jest Prospekt Emisyjny wraz z komunikatami aktualizującymi oraz ewentualnymi suplementami dostępne na stronie internetowej Spółki: https://poltreg.tech/oferta-publiczna/. Znajduje się tam również szczegółowa lista Punktów Obsługi Klienta Domów Maklerskich przyjmujących zapisy.
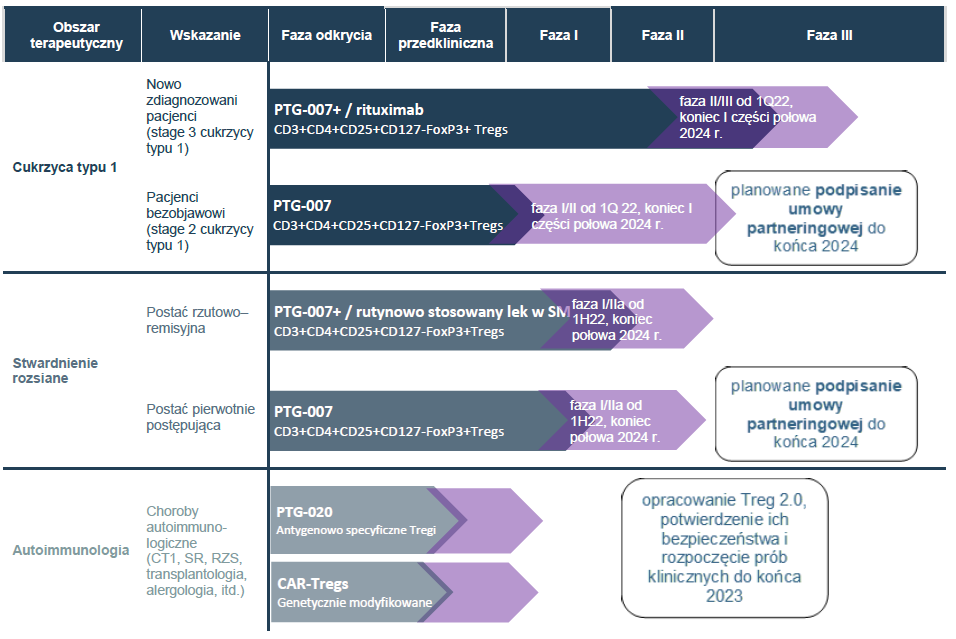
Podsumowanie zaawansowania prac badawczo-rozwojowych
Obecne zaawansowanie badań rejestracyjnych dwóch terapii opracowanych przez Spółkę jest znaczne, stąd też Zarząd przygotowuje się do podjęcia aktywnych działań w celu zawarcia umów partneringowych, a decyzje w tym zakresie będą podejmowane przede wszystkim w zależności od potencjalnych warunków przedmiotowych umów. W ocenie Zarządu etap rozwoju Spółki daje możliwość zawarcia przedmiotowych umów do końca 2024 r. Etap zaawansowania działań:
- poziom technologiczny TRL9 – metoda jest na etapie przemysłowym i możliwe jest oferowanie produktu komercyjnie.
Spółka oferuje już (w ograniczonym zakresie) leczenie dzieci opracowaną terapią cukrzycy typu 1. W 2016 roku EMA nadała tej terapii status ATMP (Advanced Therapy Medicinal Products) – terapii eksperymentalnej, umożliwiający jej komercyjne zastosowanie w ramach wyjątku szpitalnego, czyli na terenie szpitala, w którym produkowany jest lek, pod opieką i na odpowiedzialność lekarza zlecającego terapię. Wyjątek szpitalny realizowany jest we współpracy z Uniwersyteckim Centrum Klinicznym przy Gdańskim Uniwersytecie Medycznym od 2019 roku, obecna umowa obowiązuje do połowy 2023 roku. Do końca września 2021 roku terapię Spółki zastosowano u 15 dzieci (w tym kilku z zagranicy).; - feasibility studies/proof-of-concept – badania prowadzone od roku 2007 do 2012 w chorobie przeszczep przeciw gospodarzowi po przeszczepie szpiku (pierwsze badania na świecie);
- w cukrzycy typu 1 u dzieci w roku 2015 Spółka zakończyła I fazę badań klinicznych, a w roku 2020 zakończyło się badanie fazy I/II. Obecnie przygotowywane jest badanie fazy II/III realizowane w standardzie komercyjnym. Spółka pozyskała w tym celu grant z Horyzont2020/instrument SME – jako jedyna spółka biotechnologiczna z Polski przeszła do finalnego etapu tego konkursu. W ramach tego instrumentu Spółka współpracuje z doświadczonym doradcą CRO – Parexel International (IRL) Limited z siedzibą w Irlandii należącym do grupy Parexel International z siedzibą w USA, i przeprowadziła dialog z Europejską Agencją Leków, tzw. Scientific Advice, który umożliwi wypracowanie protokołu badania klinicznego gwarantującego rejestrację centralną i zgodę na wprowadzenie na rynek unijny, tzw. marketing authorisation (MAA). Na Datę Prospektu Spółka ustaliła z Parexel tzw. synopsis badania klinicznego dla terapii cukrzycy typu 1 (czyli streszczenie protokołu takiego badania). Rejestracja terapii Spółki przez EMA byłoby pierwszym przypadkiem rejestracji oryginalnej terapii komórkowej z Polski na terenie EU. Dzięki pozyskaniu renomowanej firmy CRO, wyniki badań europejskich zostaną użyte także w dialogu rejestracyjnym z regulatorem z USA, tj. FDA.
- w stwardnieniu rozsianym Spółka zakończył I fazę badań klinicznych i przygotowywany jest protokół fazy I/IIa;
- w fazie badań przedklinicznych znajduje się nowa wersja preparatu (Treg 2.0) o lepszych właściwościach tzw. antygenowo- specyficznych („inteligentny” lek kierowany do konkretnych tkanek, co ogranicza skutki uboczne w innych tkankach). Na potrzeby rozwoju Treg 2.0 Spółka rozważa nawiązanie współpracy z zewnętrznym ośrodkiem akademickim albo komercyjnym prowadzącym zaawansowane prace w tym obszarze.
Projekty badawczo-rozwojowe realizowane przez PolTREG S.A.
 |
| Źródło: Spółka |
W dniu 8 października 2021 roku Spółka zawarła z AZTherapies, Inc. z siedzibą w Bostonie (USA) list intencyjny opisujący zamiar stron zawarcia w ciągu 90 dni umowy regulującej zasady współpracy w zakresie zastosowania komórek CAR-TREG w leczeniu chorób neurologicznych o podłożu autoimmunologicznym. PolTREG dąży do tego by negocjowana umowa przewidywała, że Spółka otrzyma wyłączną licencję na technologię CAR-TREG rozwijaną do tej pory w AZTherapies oraz będzie prowadził dalsze badania i rozwój połączonych technologii dotyczących CAR-TREG, aż do wyników badania klinicznego fazy I/II w wytypowanej jednostce chorobowej. PolTREG, jako wyłączny licencjobiorca technologii, będzie stroną umowy partneringowej, przy czym powyżej ustalonej wartości total biodollar Spółka ma prawo samodzielnie podjąć decyzję o zawarciu partneringu. Jednym z istotnych celów negocjowanej współpracy jest przygotowanie dokumentacji pozwalającej na rozpoczęcie badania klinicznego I/II fazy w wytypowanym obszarze (najprawdopodobniej stwardnienie rozsiane boczne), w terminie 12-18 miesięcy od podpisania umowy.
Obecnie nie ma na świecie żadnego zarejestrowanego leku, który mógłby zatrzymać lub spowolnić przebieg świeżo zdiagnozowanej cukrzycy typu 1, dlatego mamy ogromną niezaspokojoną potrzebę medyczną w skali globalnej. PolTREG widzi dużą szansę na opracowanie przełomowej terapii, która od strony klinicznej jest już mocno zaawansowana, z relatywnie dużą liczbą przebadanych pacjentów.
Nasza terapia to duża szansa dla chorych na cukrzycę, ponieważ może zmienić ich komfort życia poprzez zmniejszenie powikłań, ograniczenie dawek przyjmowanej insuliny do nawet całkowitego uniezależnienia się od insuliny. Dostrzegamy także olbrzymi potencjał w terapiach z wykorzystaniem komórek T-regulatorowych (TREGS) w leczeniu stwardnienia rozsianego i innych chorobach autoimmunologicznych. W przypadku świeżo zdiagnozowanej cukrzycy typu pierwszego mówimy o 40 tys. nowych przypadków rocznie w USA i ok. 30 tys. w Unii Europejskiej. W przypadku cukrzycy przedobjawowej, którą przy odpowiednich badaniach przesiewowych można wcześnie wykrywać, mówimy o co najmniej 60 tys. pacjentów rocznie łącznie na tych rynkach. Na stwardnienie rozsiane choruje ok. 2,8 mln osób na świecie. Szacujemy, że w USA i EU ok. 250 tys. pacjentów mogłoby kwalifikować się do terapii komórkami TREG na tych rynkach – podsumował Mariusz Jabłoński, członek zarządu PolTREG S.A.
Model Biznesowy
PolTREG chce rozwijać swoje projekty badawcze do zaawansowanej fazy, a następnie pozyskać partnera wśród dużych firm farmaceutycznych, które są w stanie sfinansować dalsze badania oraz wprowadzić terapię na rynek i dostarczyć ją potrzebującym pacjentom. Celem Spółki jest podjęcie aktywnych działań w celu zawarcia przedmiotowych umów, co w ocenie Spółki jest prawdopodobne na etapie zaawansowanego lub zakończonego badania II fazy, a decyzja w tym zakresie będzie podejmowana w zależności od proponowanych przez partnerów warunków. W typowej strukturze obejmuje 3 etapy płatności: opłatę wstępną (ang. up-front payment), okresowe płatności zależne od realizacji kamieni milowych (ang. milestone payments) i tantiemy od sprzedaży terapii (ang. royalties).
Naszym celem jest przeprowadzenie kolejnych etapów badań klinicznych, zarówno dla terapii cukrzycy typu 1, jak i stwardnienia rozsianego i doprowadzić je do momentu, kiedy będzie możliwe zawarcie umów partneringowych, prawdopodobnie na etapie zaawansowanego lub zakończonego badania II/III fazy dla cukrzycy typu 1 w fazie objawowej i badania fazy I/II cukrzycy przedobjawowej oraz badania fazy I/II w stwardnieniu rozsianym. Zakładamy, że w połowie 2024 roku uzyskamy wyniki analizy śródokresowej w badaniach cukrzycy typu 1 oraz wyniki końcowe dla badania stwardnienia rozsianego, które będą stanowiły ważny element naszego pakietu danych w procesie pozyskania partnera branżowego z „big pharmy”. Spodziewamy się, że taki partner wesprze nasze dalsze badania kliniczne i nowe obszary terapeutyczne, a także wzmocni nasze kompetencje w komercjalizacji projektów zarówno w obszarze cukrzycy, jak i stwardnienia rozsianego – powiedział prof. dr. hab. n. med. Piotr Trzonkowski, prezes zarządu, współzałożyciel i akcjonariusz PolTREG S.A.
Spółka finansuje realizację projektów badawczo-rozwojowych w oparciu o granty oraz środki pozyskane od prywatnych inwestorów. Dotychczas pozyskała z grantów ok. 28,8 mln zł, z czego 12,2 mln zł na rozwój Metody TREG, a pozostała część między innymi na powstanie centrum badawczo-rozwojowego i nowego laboratorium.
Spółka prowadzi obecnie budowę własnego, nowoczesnego centrum badawczo-rozwojowego przeznaczonego do rozwoju i stosowania metody TREG w innowacyjnych terapiach chorób autoimmunologicznych, na którego powstanie pozyskała dofinansowanie w wysokości ponad 10,5 mln zł ze środków z Europejskiego Funduszu Rozwoju Regionalnego. Ponadto w sierpniu 2021 r. zostało Spółce przyznane dofinansowanie w wysokości ponad 6 mln zł na utworzenie, wyposażenie i uruchomienie nowego laboratorium produkcyjnego przeznaczonego do komercyjnej produkcji preparatów TREGS.
Zatrudniamy obecnie ponad 20 pracowników, a po uruchomieniu nowego laboratorium ta liczba co najmniej się podwoi – chcemy poszerzyć nasz zespół przede wszystkim o specjalistów w obszarze immunologii, biologii molekularnej i biotechnologii, którzy chcą uczestniczyć w tym przełomowym przedsięwzięciu, jakim jest rozwój w PolTREGu terapii na choroby dotychczas nieuleczalne. Zakładamy, że zakończenie budowy laboratorium badawczego i produkcyjnego oraz jego wyposażenie nastąpi w pierwszym półroczu 2022 r. Spodziewamy się, że w tym samym czasie uzyskamy wszystkie wymagane certyfikacje i możliwe będzie uruchomienie laboratorium i dalsze prowadzenie badań i terapii komercyjnych już w oparciu o tę rozbudowaną własną infrastruktur” – mówi Kamilla Bok, członek zarządu PolTREG S.A.
Strategia
W prospekcie Spółka szeroko opisuje swoje cele strategiczne. Najbliższe cele, planowane na 2022 rok, obejmują:
- Uzyskanie zgód prezesa Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych na przeprowadzenie badań klinicznych fazy II/III dla cukrzycy objawowej typu 1 oraz fazy I/II dla cukrzycy przed objawowej typu 1 – I kw. 2022 roku;
- Uzyskanie zgód prezesa Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych na przeprowadzenie badań klinicznych fazy I/IIa dla stwardnienia rozsianego w postaci pierwotnie postępującej oraz rzutowo remisyjnej – I pólrocze 2022 roku;
- Podanie pierwszego preparatu w badaniu fazy II/III dla cukrzycy objawowej typu 1 z zachowaniem wszystkich zaleceń uzyskanych od EMA na etapie Scientific Advice po pozyskaniu środków z Emisji – III kw. 2022 oku;
- Podanie pierwszego preparatu w badaniu fazy I/II dla cukrzycy przed objawowej typu 1 – III kw. 2022 roku;
- Podanie pierwszego preparatu w badaniu fazy I/IIa dla stwardnienia rozsianego w postaci pierwotnie postępującej po pozyskaniu środków z Emisji – III kw. 2022 roku;
- Podanie pierwszego preparatu w badaniu fazy I/IIa dla stwardnienia rozsianego w postaci rzutowo remisyjnej po pozyskaniu środków z Emisji – III kw. 2022 roku;
- Dalsze leczenie pacjentów w ramach wyjątku szpitalnego – co najmniej 50 preparatów w ciągu najbliższego roku, a następnie 8 podań miesięcznie;
- Ukończenie budowy własnego nowoczesnego centrum badawczo-rozwojowego – I półrocze 2022 roku;
- Uruchomienie laboratorium – II kw. 2022 roku;
- Ukończenie długookresowej analizy bezpieczeństwa terapii TREGS dla pacjentów leczonych w poprzednich badaniach klinicznych – do końca 2022 roku.
Spółka jest w trakcie realizacji inwestycji mającej na celu stworzenie nowoczesnego centrum badawczo-rozwojowego oraz produkcyjnego przeznaczonego do rozwoju i stosowania metody TREG w innowacyjnych terapiach chorób autoimmunologicznych. Laboratorium będzie przyszłym miejscem produkcji TREGS zarówno na potrzeby prowadzenia dalszych prac badawczo-rozwojowych, w tym przygotowywanych badań klinicznych terapii cukrzycy typu 1 u dzieci i terapii stwardnienia rozsianego, jak i wykorzystywanych w terapiach realizowanych w oparciu o wyjątek szpitalny. Po dopuszczeniu terapii Spółki do obrotu będzie również wykorzystywane na potrzeby produkcji preparatów dla pacjentów.
Niniejszy artykuł stanowi wyłącznie materiał prasowy w rozumieniu art. 7 ust. 2 pkt 4) ustawy z dnia 26 stycznia 1984 r. prawo prasowe (Dz.U. z 2018 r. poz. 1914), w szczególności niniejszy artykuł nie stanowi oferty ani zaproszenia do nabywania papierów wartościowych lub jakiejkolwiek innej formy oferowania instrumentów finansowych w rozumieniu ustawy o ofercie publicznej i warunkach wprowadzania instrumentów finansowych do zorganizowanego systemu obrotu oraz o spółkach publicznych.



